FÍSICO-QUÍMICA II
Numa dada temperatura, a velocidade de uma reação é diretamente proporcional ao produto das concentrações em mol/L dos reagentes elevadas às potências que dependem do mecanismo da reação. Em um recipiente a 25°C ocorre a reação entre os gases A e B, segundo a equação da Lei da Velocidade V = k.[A].[B].
O que acontece com a velocidade da reação quando:
I – aumentamos a pressão (diminuímos o volume)
II – aumentamos o número de mols de A
III – diminuímos a temperatura a volume constante
Assinale a alternativa que apresenta a sequência correta:
I, diminui; II, diminui; III, permanece constante.
I, permanece constante; II, permanece constante; III, aumenta.
I, aumenta; II, permanece constante; III, diminui.
I, aumenta; II, aumenta; III, diminui.
I, permanece constante; II, aumenta; III, diminui.
Analisando a reação reversível abaixo, quando se estabelece o equilíbrio químico é possível afirmar que: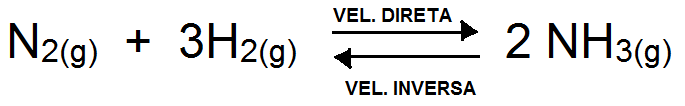
Vel. direta < Vel. inversa.
[N2] = [NH3].
Vel. direta > Vel. inversa.
[N2] = [H2].
[NH3] = constante.
Sabemos que alguns fatores interferem na velocidade de uma reação química. Com base nesses fatores, relacione a coluna I (fenômenos) com a coluna II (fatores que interferem na cinética das reações químicas):
Coluna I
1 - Queimadas alastrando-se rapidamente quando está ventando;
2 - Conservação dos alimentos no refrigerador;
3 - Efervescência da água oxigenada na higiene de ferimentos;
4 - Lascas de madeiras queimando mais rapidamente que uma tora de madeira.
Coluna II
A - superfície de contato
B - catalisador
C - concentração
D – temperatura
1 - D; 2 - C; 3 - B; 4 – A.
1 - C; 2 - D; 3 - B; 4 – A.
1 - A; 2 - B; 3 - C; 4 – D.
1 - B; 2 - C; 3 - D; 4 – A.
1 - C; 2 - D; 3 - A; 4 – B.
Para uma dada reação química, expressa como A + B, sabe-se que a concentração de A se reduz à metade em cada intervalo de tempo de 30 min. Se a concentração inicial de A for de 1M, após quanto tempo ela atingirá o valor de 0,125M?
40 mim
90 mim
120 mim
150 mim
60 min
Em um laboratório, montou-se uma pilha contendo eletrodos de zinco e níquel, mergulhados em soluções com as concentrações indicadas abaixo. Utilize a equação de Nernst, e determine a energia gerada pela célula galvânica a 25oC.
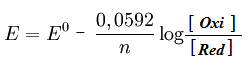
- Zn(s)/Zn2+(aq) //Ni2+(aq) /Ni(s)
- [Zn2+] = 0,57 mol/L e [Ni2+] = 0,079 mol/L
- Eºred Zn = - 0,76 v
- Eºred Ni = - 0,25 v
E = 0,850 V.
E = 0,534 V.
E = 0,759 V.
E = 0,510 V.
E = 0,485 V.
Hidrogênio e iodo gasosos, foram misturados em condições reacionais adequadas gerando HI como produto através de uma reação endotérmica. A reação, em estado de equilíbrio, é representada por: H2(g) + I2(g) → 2 HI(g). Em um recipiente com capacidade de 2,0 L foram colocados 1 mol de H2 e 1 mol de I2. Após ter estabelecido o equilíbrio a 430 oC, verificou-se que o valor da constante de equilíbrio foi 49. As concentrações em mol.L-1no equilíbrio das espécies H2, I2, e HI são respectivamente:
1,554 M, 0,223 M e 0,223 M
0,223 M, 0,223 M, e 1,554 M
0,446 M, 0,446 M e 3,108 M
0,111 M, 0,111 M e 0,778 M
0,778 M, 0,111 M e 0,111 M

- 558 kJ.mol-1
+ 585 kJ.mol-1
+ 177 kJ.mol-1
- 204 kJ.mol-1
+ 558 kJ.mol-1
A constante de Kc para 2SO2(g) + O2(g) <--> 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes, nesta temperatura, dá os seguintes resultados [SO3] = 0,262 mol L-1, [SO2] = 0,0149 mol L-1, [O2] = 0,0449 mol L-1. O sistema está em equilíbrio?
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo: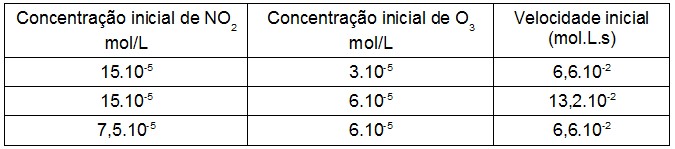
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:
I, diminui; II, diminui; III, permanece constante.
I, permanece constante; II, permanece constante; III, aumenta.
I, aumenta; II, permanece constante; III, diminui.
I, aumenta; II, aumenta; III, diminui.
I, permanece constante; II, aumenta; III, diminui.
Analisando a reação reversível abaixo, quando se estabelece o equilíbrio químico é possível afirmar que:
Vel. direta < Vel. inversa.
[N2] = [NH3].
Vel. direta > Vel. inversa.
[N2] = [H2].
[NH3] = constante.
Sabemos que alguns fatores interferem na velocidade de uma reação química. Com base nesses fatores, relacione a coluna I (fenômenos) com a coluna II (fatores que interferem na cinética das reações químicas):
Coluna I
1 - Queimadas alastrando-se rapidamente quando está ventando;
2 - Conservação dos alimentos no refrigerador;
3 - Efervescência da água oxigenada na higiene de ferimentos;
4 - Lascas de madeiras queimando mais rapidamente que uma tora de madeira.
Coluna II
A - superfície de contato
B - catalisador
C - concentração
D – temperatura
1 - D; 2 - C; 3 - B; 4 – A.
1 - C; 2 - D; 3 - B; 4 – A.
1 - A; 2 - B; 3 - C; 4 – D.
1 - B; 2 - C; 3 - D; 4 – A.
1 - C; 2 - D; 3 - A; 4 – B.
Para uma dada reação química, expressa como A + B, sabe-se que a concentração de A se reduz à metade em cada intervalo de tempo de 30 min. Se a concentração inicial de A for de 1M, após quanto tempo ela atingirá o valor de 0,125M?
40 mim
90 mim
120 mim
150 mim
60 min
Em um laboratório, montou-se uma pilha contendo eletrodos de zinco e níquel, mergulhados em soluções com as concentrações indicadas abaixo. Utilize a equação de Nernst, e determine a energia gerada pela célula galvânica a 25oC.
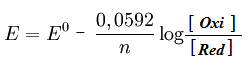
- Zn(s)/Zn2+(aq) //Ni2+(aq) /Ni(s)
- [Zn2+] = 0,57 mol/L e [Ni2+] = 0,079 mol/L
- Eºred Zn = - 0,76 v
- Eºred Ni = - 0,25 v
E = 0,850 V.
E = 0,534 V.
E = 0,759 V.
E = 0,510 V.
E = 0,485 V.
Hidrogênio e iodo gasosos, foram misturados em condições reacionais adequadas gerando HI como produto através de uma reação endotérmica. A reação, em estado de equilíbrio, é representada por: H2(g) + I2(g) → 2 HI(g). Em um recipiente com capacidade de 2,0 L foram colocados 1 mol de H2 e 1 mol de I2. Após ter estabelecido o equilíbrio a 430 oC, verificou-se que o valor da constante de equilíbrio foi 49. As concentrações em mol.L-1no equilíbrio das espécies H2, I2, e HI são respectivamente:
1,554 M, 0,223 M e 0,223 M
0,223 M, 0,223 M, e 1,554 M
0,446 M, 0,446 M e 3,108 M
0,111 M, 0,111 M e 0,778 M
0,778 M, 0,111 M e 0,111 M

- 558 kJ.mol-1
+ 585 kJ.mol-1
+ 177 kJ.mol-1
- 204 kJ.mol-1
+ 558 kJ.mol-1
A constante de Kc para 2SO2(g) + O2(g) <--> 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes, nesta temperatura, dá os seguintes resultados [SO3] = 0,262 mol L-1, [SO2] = 0,0149 mol L-1, [O2] = 0,0449 mol L-1. O sistema está em equilíbrio?
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo:
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:

Vel. direta < Vel. inversa.
[N2] = [NH3].
Vel. direta > Vel. inversa.
[N2] = [H2].
[NH3] = constante.
Sabemos que alguns fatores interferem na velocidade de uma reação química. Com base nesses fatores, relacione a coluna I (fenômenos) com a coluna II (fatores que interferem na cinética das reações químicas):
Coluna I
1 - Queimadas alastrando-se rapidamente quando está ventando;
2 - Conservação dos alimentos no refrigerador;
3 - Efervescência da água oxigenada na higiene de ferimentos;
4 - Lascas de madeiras queimando mais rapidamente que uma tora de madeira.
Coluna II
A - superfície de contato
B - catalisador
C - concentração
D – temperatura
1 - D; 2 - C; 3 - B; 4 – A.
1 - C; 2 - D; 3 - B; 4 – A.
1 - A; 2 - B; 3 - C; 4 – D.
1 - B; 2 - C; 3 - D; 4 – A.
1 - C; 2 - D; 3 - A; 4 – B.
Para uma dada reação química, expressa como A + B, sabe-se que a concentração de A se reduz à metade em cada intervalo de tempo de 30 min. Se a concentração inicial de A for de 1M, após quanto tempo ela atingirá o valor de 0,125M?
40 mim
90 mim
120 mim
150 mim
60 min
Em um laboratório, montou-se uma pilha contendo eletrodos de zinco e níquel, mergulhados em soluções com as concentrações indicadas abaixo. Utilize a equação de Nernst, e determine a energia gerada pela célula galvânica a 25oC.
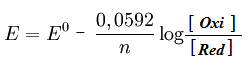
- Zn(s)/Zn2+(aq) //Ni2+(aq) /Ni(s)
- [Zn2+] = 0,57 mol/L e [Ni2+] = 0,079 mol/L
- Eºred Zn = - 0,76 v
- Eºred Ni = - 0,25 v
E = 0,850 V.
E = 0,534 V.
E = 0,759 V.
E = 0,510 V.
E = 0,485 V.
Hidrogênio e iodo gasosos, foram misturados em condições reacionais adequadas gerando HI como produto através de uma reação endotérmica. A reação, em estado de equilíbrio, é representada por: H2(g) + I2(g) → 2 HI(g). Em um recipiente com capacidade de 2,0 L foram colocados 1 mol de H2 e 1 mol de I2. Após ter estabelecido o equilíbrio a 430 oC, verificou-se que o valor da constante de equilíbrio foi 49. As concentrações em mol.L-1no equilíbrio das espécies H2, I2, e HI são respectivamente:
1,554 M, 0,223 M e 0,223 M
0,223 M, 0,223 M, e 1,554 M
0,446 M, 0,446 M e 3,108 M
0,111 M, 0,111 M e 0,778 M
0,778 M, 0,111 M e 0,111 M

- 558 kJ.mol-1
+ 585 kJ.mol-1
+ 177 kJ.mol-1
- 204 kJ.mol-1
+ 558 kJ.mol-1
A constante de Kc para 2SO2(g) + O2(g) <--> 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes, nesta temperatura, dá os seguintes resultados [SO3] = 0,262 mol L-1, [SO2] = 0,0149 mol L-1, [O2] = 0,0449 mol L-1. O sistema está em equilíbrio?
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo:
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:
1 - Queimadas alastrando-se rapidamente quando está ventando;
2 - Conservação dos alimentos no refrigerador;
3 - Efervescência da água oxigenada na higiene de ferimentos;
4 - Lascas de madeiras queimando mais rapidamente que uma tora de madeira.
A - superfície de contato
B - catalisador
C - concentração
D – temperatura
1 - D; 2 - C; 3 - B; 4 – A.
1 - C; 2 - D; 3 - B; 4 – A.
1 - A; 2 - B; 3 - C; 4 – D.
1 - B; 2 - C; 3 - D; 4 – A.
1 - C; 2 - D; 3 - A; 4 – B.
Para uma dada reação química, expressa como A + B, sabe-se que a concentração de A se reduz à metade em cada intervalo de tempo de 30 min. Se a concentração inicial de A for de 1M, após quanto tempo ela atingirá o valor de 0,125M?
40 mim
90 mim
120 mim
150 mim
60 min
Em um laboratório, montou-se uma pilha contendo eletrodos de zinco e níquel, mergulhados em soluções com as concentrações indicadas abaixo. Utilize a equação de Nernst, e determine a energia gerada pela célula galvânica a 25oC.
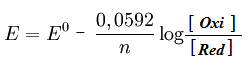
- Zn(s)/Zn2+(aq) //Ni2+(aq) /Ni(s)
- [Zn2+] = 0,57 mol/L e [Ni2+] = 0,079 mol/L
- Eºred Zn = - 0,76 v
- Eºred Ni = - 0,25 v
E = 0,850 V.
E = 0,534 V.
E = 0,759 V.
E = 0,510 V.
E = 0,485 V.
Hidrogênio e iodo gasosos, foram misturados em condições reacionais adequadas gerando HI como produto através de uma reação endotérmica. A reação, em estado de equilíbrio, é representada por: H2(g) + I2(g) → 2 HI(g). Em um recipiente com capacidade de 2,0 L foram colocados 1 mol de H2 e 1 mol de I2. Após ter estabelecido o equilíbrio a 430 oC, verificou-se que o valor da constante de equilíbrio foi 49. As concentrações em mol.L-1no equilíbrio das espécies H2, I2, e HI são respectivamente:
1,554 M, 0,223 M e 0,223 M
0,223 M, 0,223 M, e 1,554 M
0,446 M, 0,446 M e 3,108 M
0,111 M, 0,111 M e 0,778 M
0,778 M, 0,111 M e 0,111 M

- 558 kJ.mol-1
+ 585 kJ.mol-1
+ 177 kJ.mol-1
- 204 kJ.mol-1
+ 558 kJ.mol-1
A constante de Kc para 2SO2(g) + O2(g) <--> 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes, nesta temperatura, dá os seguintes resultados [SO3] = 0,262 mol L-1, [SO2] = 0,0149 mol L-1, [O2] = 0,0449 mol L-1. O sistema está em equilíbrio?
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo:
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:
40 mim
90 mim
120 mim
150 mim
60 min
Em um laboratório, montou-se uma pilha contendo eletrodos de zinco e níquel, mergulhados em soluções com as concentrações indicadas abaixo. Utilize a equação de Nernst, e determine a energia gerada pela célula galvânica a 25oC.
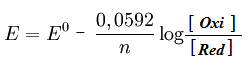
- Zn(s)/Zn2+(aq) //Ni2+(aq) /Ni(s)
- [Zn2+] = 0,57 mol/L e [Ni2+] = 0,079 mol/L
- Eºred Zn = - 0,76 v
- Eºred Ni = - 0,25 v
E = 0,850 V.
E = 0,534 V.
E = 0,759 V.
E = 0,510 V.
E = 0,485 V.
Hidrogênio e iodo gasosos, foram misturados em condições reacionais adequadas gerando HI como produto através de uma reação endotérmica. A reação, em estado de equilíbrio, é representada por: H2(g) + I2(g) → 2 HI(g). Em um recipiente com capacidade de 2,0 L foram colocados 1 mol de H2 e 1 mol de I2. Após ter estabelecido o equilíbrio a 430 oC, verificou-se que o valor da constante de equilíbrio foi 49. As concentrações em mol.L-1no equilíbrio das espécies H2, I2, e HI são respectivamente:
1,554 M, 0,223 M e 0,223 M
0,223 M, 0,223 M, e 1,554 M
0,446 M, 0,446 M e 3,108 M
0,111 M, 0,111 M e 0,778 M
0,778 M, 0,111 M e 0,111 M

- 558 kJ.mol-1
+ 585 kJ.mol-1
+ 177 kJ.mol-1
- 204 kJ.mol-1
+ 558 kJ.mol-1
A constante de Kc para 2SO2(g) + O2(g) <--> 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes, nesta temperatura, dá os seguintes resultados [SO3] = 0,262 mol L-1, [SO2] = 0,0149 mol L-1, [O2] = 0,0449 mol L-1. O sistema está em equilíbrio?
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo:
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:
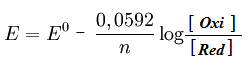
E = 0,850 V.
E = 0,534 V.
E = 0,759 V.
E = 0,510 V.
E = 0,485 V.
Hidrogênio e iodo gasosos, foram misturados em condições reacionais adequadas gerando HI como produto através de uma reação endotérmica. A reação, em estado de equilíbrio, é representada por: H2(g) + I2(g) → 2 HI(g). Em um recipiente com capacidade de 2,0 L foram colocados 1 mol de H2 e 1 mol de I2. Após ter estabelecido o equilíbrio a 430 oC, verificou-se que o valor da constante de equilíbrio foi 49. As concentrações em mol.L-1no equilíbrio das espécies H2, I2, e HI são respectivamente:
1,554 M, 0,223 M e 0,223 M
0,223 M, 0,223 M, e 1,554 M
0,446 M, 0,446 M e 3,108 M
0,111 M, 0,111 M e 0,778 M
0,778 M, 0,111 M e 0,111 M

- 558 kJ.mol-1
+ 585 kJ.mol-1
+ 177 kJ.mol-1
- 204 kJ.mol-1
+ 558 kJ.mol-1
A constante de Kc para 2SO2(g) + O2(g) <--> 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes, nesta temperatura, dá os seguintes resultados [SO3] = 0,262 mol L-1, [SO2] = 0,0149 mol L-1, [O2] = 0,0449 mol L-1. O sistema está em equilíbrio?
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo:
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:
1,554 M, 0,223 M e 0,223 M
0,223 M, 0,223 M, e 1,554 M
0,446 M, 0,446 M e 3,108 M
0,111 M, 0,111 M e 0,778 M
0,778 M, 0,111 M e 0,111 M

- 558 kJ.mol-1
+ 585 kJ.mol-1
+ 177 kJ.mol-1
- 204 kJ.mol-1
+ 558 kJ.mol-1
A constante de Kc para 2SO2(g) + O2(g) <--> 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes, nesta temperatura, dá os seguintes resultados [SO3] = 0,262 mol L-1, [SO2] = 0,0149 mol L-1, [O2] = 0,0449 mol L-1. O sistema está em equilíbrio?
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo:
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:

- 558 kJ.mol-1
+ 585 kJ.mol-1
+ 177 kJ.mol-1
- 204 kJ.mol-1
+ 558 kJ.mol-1
A constante de Kc para 2SO2(g) + O2(g) <--> 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes, nesta temperatura, dá os seguintes resultados [SO3] = 0,262 mol L-1, [SO2] = 0,0149 mol L-1, [O2] = 0,0449 mol L-1. O sistema está em equilíbrio?
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo:
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:
Não, pois nestas condições o Kc é 102,5.
Não, pois nestas condições o Kc é 450.
Não, pois nestas condições o Kc é 1,45 x 10-4.
Sim, o sistema está em equilíbrio.
Não, pois nestas condições o Kc é 6882.
A reação entre o dióxido de nitrogênio e o ozônio, que forma trióxido de nitrogênio é uma das principais responsáveis pela poluição urbana.
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida, determine a expressão da velocidade e o valor da constante da velocidade desse processo:
v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:

v = k · [NO2] + [O3] e 2,2. 107
v = k · [O3] e 4,4. 107
v = k · [NO2] e 2,2. 107
v = k · [NO2] [O3] e 1,5. 107
v = k · [NO2] [O3] e 2,0. 107
O efeito poluente de destruição da camada de ozônio, que protege a terra da ação dos raios UV-A e UV-B, só não é mais prejudicial à vida humana, devido a recomposição natural desse ozônio. Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da seqüência de reações representadas a seguir:
I. N2 + O2 ----> 2 NO
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3
Considerando as reações no sentido direto, pode-se afirmar que ocorre oxidação do nitrogênio:
II. 2 NO + O2 ----> 2 NO2
III. NO2 + O2 ----> NO + O3